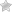Склерозирующий холангит и воспалительные заболевания кишечника: что первично?
Сотрудники «Российского национального исследовательского медицинского университет им. Н.И. Пирогова» и «Научно-исследовательского клинического института педиатрии им. академика Ю.Е. Вельтищева» подготовили обзор, посвященный – обсуждению фенотипа сочетания склерозирующего холангита и воспалительного заболевания кишечника. Представлены теории этиопатогенеза склерозирующего холангита при воспалительных заболеваниях кишечника, а также некоторые особенности фенотипа как смешанных, так и моногенных форм заболеваний.
Склерозирующий холангит – это одно из самых частых гепатологических внекишечных проявлений воспалительных заболеваний кишечника. Установлено, что примерно у 70% пациентов со склерозирующим холангитом имеется воспалительное заболевание кишечника, чаще всего язвенный колит. И наоборот, приблизительно у 5% пациентов с язвенным колитом диагностируется склерозирующий холангит. Стоит отметить, что число пациентов со склерозирующим холангитом, у которых имеется воспаление кишечника, в Японии и Сингапуре составляет 20–32% от всех пациентов с воспалительными заболеваниями кишечника, в то время как в Северной Америке и Европе достигает 60–80%.
В 1965 г. M.P. Smith и R.H. Loe впервые описали взаимосвязь между склерозирующим холангитом и воспалительными заболеваниями кишечника. С тех пор в исследованиях популяционных когорт и путем метаанализа были изучены точная распространенность и последствия склерозирующего холангита при воспалительном заболевании кишечника. Комбинация склерозирующий холангит–воспалительное заболевание кишечника описано как заболевание, характеризующееся повышенным риском развития колоректального рака и относительно спокойным течением колита. В нескольких исследованиях отмечается, что пациентам со склерозирующим холангитом и воспалительным заболеванием кишечника требуется меньше курсов глюкокортикоидов и госпитализаций, чем пациентам с изолированным воспалительным заболеванием кишечника.
Эпидемиология. На основе данных о населении из метаанализа 2017 г. распространенность воспалительных заболеваний кишечника в экономически развитых странах оценивается в 0,3%. Всемирная распространенность склерозирующего холангита в сочетании с воспалительным заболеванием кишечника определяется на уровне 0,024%, в то же время точная оценка остается неизвестной из-за различий диагностических критериев. Первичная заболеваемость склерозирующим холангитом варьирует от 0 до 1,3 на 100 тыс. жителей/год, а распространенность – от 0 до 16,2 на 100 тыс. жителей.
Имеются ограниченные данные о распространенности склерозирующего холангита в сочетании
с воспалительным заболеванием кишечника среди населения центральной и южной Европы. Согласно экстраполяции данных распространенность этого заболевания в Венгрии составляет 0,041%. Указывается, что распространенность воспалительных заболеваний кишечника ниже в южной Европе, особенно в Северо-Западной Греции. Показано, что риск развития склерозирующего холангита у мужчин в 2 раза выше, чем у женщин.
Патогенез. В настоящее время в патогенезе склерозирующего холангита рассматривается несколько теорий.
Аутоантитела служат классическим биомаркером, связанным как со склерозирующим холангитом, так и с воспалительным заболеванием кишечника. Перинуклеарные антинейтрофильные цитоплазматические антитела (pANCA) – один из таких маркеров, классически связанных с обоими указанными заболеваниями. Частота выявления этих аутоантител в сыворотке пациентов со склерозирующим холангитом в отсутствие воспалительного заболевания кишечника составляет 25–77%, при склерозирующем холангите в сочетании с воспалительным заболеванием кишечника – 23–88%. Мишенями pANCA при склерозирующем холангите служат как лактоферрин, так и тубулин-бета-изотоп 5, тогда как при язвенном колите мишенью служит ядерный гистон, что указывает на различную роль этого антитела в патогенезе обоих заболеваний. Была изучена высота экспрессии определенного изотипа подклассов иммуноглобулина G (IgG) pANCA при склерозирующем холангите и язвенном колите. S.R. Targan и соавт. обнаружили, что при склерозирующем холангите преобладают подтипы pANCA IgG1 и IgG3, в то время как F. Seibold и соавт. отметили, что при язвенном колите преобладает IgG1.Он не является уникальным для склерозирующего холангита и язвенного колита – он экспрессируется и при аутоиммунном гепатите. C. Roozendaal и соавт. обнаружили, что у пациентов со склерозирующим холангитом наличие pANCA было связано со снижением уровня сывороточного альбумина и увеличением активности щелочной фосфатазы; это наводит на мысль о более высокой активности заболевания. Дополнительные исследования демонстрируют более высокую частоту рецидивов у pANCA-положительных пациентов с язвенным колитом по сравнению с контрольной группой, что потенциально указывает на прогностическую роль этих аутоантител. Наличие pANCA при болезни Крона ассоциируется с клиническим фенотипом, напоминающим язвенный колит, и является прогностическим признаком тяжелого заболевания в 5-летний период после установления диагноза.
Генетические факторы. Генетические исследования выявили более 150 участков ДНК, представляющих интерес в локусах, ассоциирующихся с воспалительными заболеваниями кишечника, общих для язвенного колита и болезни Крона, в то время как в других исследованиях выявлено 9 локусов, связанных с развитием склерозирующего холангита.
Желчные кислоты. Изучен компонент взаимодействия желчных кислот и микробиома при воспалительных заболеваниях кишечника и показаны данные, свидетельствующие, что некоторые продукты желчных кислот, обнаруживающиеся у пациентов с воспалительными заболеваниями кишечника в результате дисбаланса кишечной микробиоты, дают потенциальный провоспалительный эффект. Вторичные желчные кислоты считаются противовоспалительными по природе, так как в исследованиях in vitro показано, что они ингибируют высвобождение фактора некроза опухоли альфа (TNF-α), интерлейкина (IL)-1B и IL-6 из макрофагов. Было обнаружено, что вторичные желчные кислоты, например литохолевая кислота, оказывают дозозависимый противовоспалительный эффект.
Установлено, что концентрация вторичных желчных кислот в кале была обратно пропорциональна активности воспалительных заболеваний кишечника: отмечены их высокие концентрации в кале в контрольной группе и низкие – у пациентов с активным воспалительным заболеванием кишечника.
Теория «самонаведения лимфоцитов». Теории, направленные на установление иммунологических связей между двумя заболеваниями, были предложены совсем недавно. Первая из этих гипотез предполагает, что лимфоциты слизистой оболочки кишечника активируются у пациентов с воспалительными заболеваниями кишечника. Клинически эта теория подтверждается наблюдением, показывающим, что склерозирующий холангит может развиваться после тотальной колэктомии у пациентов с воспалительным заболеванием кишечника и что степень заболевания печени мало коррелирует с активностью воспалительного процесса в кишечнике. В этом семействе молекул адгезии наиболее широко признан продукт гена ITGB7 (бета-субъединица интегрина α4β7), также известный как молекула 1 патч-адгезии лимфоцитов островков Пейера. Моноклональное антитело α4β7 (ведолизумаб) было одобрено для лечения воспалительных заболеваний кишечника. Было выдвинуто предположение, что, поскольку лимфоциты α4β7+ проникают в печень при склерозирующем холангите, моноклональное антитело для этой молекулы интегрина может потенциально оказывать противовоспалительное действие в печени. B. Christensen и соавт. обнаружили, что, хотя клиническая активность заболевания кишечника значительно снизилась после лечения ведолизумабом, к сожалению, биохимическая активность заболевания печени и показатель риска склерозирующего холангита по Майо значительно не изменились у пациентов со склерозирующим холангитом, сочетающимся с воспалительным заболеванием кишечника.
Модель «протекающей кишки». Хроническое воспаление в кишечнике вызывает повышенную проницаемость слизистой оболочки. Это делает его восприимчивым к транслокации бактерий и бактериальных продуктов, которые проникают в энтерогепатическую циркуляцию и приводят к воспалению печени. На моделях крыс показано, что посредством энтерогепатического кровообращения грамотрицательные и анаэробные бактериальные компоненты, такие как полисахариды пептидогликаны или хемотаксические пептиды вызывают поражение печени, напоминающее склерозирующий холангит.
Кишечный дисбиоз. Исследования, направленные на выявление расхождений между кишечным микробиомом, отметили увеличение родов Escherichia, Fusobacterium, Ruminococcus и Megaspera у пациентов со склерозирующим холангитом и воспалительным заболеванием кишечника. Эти же исследования показали также, что другие микроорганизмы, в том числе Prevotella, Roseburia, Dorea, Blautia и Bacterioides, были представлены меньшей популяцией. Установлено, что увеличение количества Veillonella было связано с более тяжелым течением склерозирующего холангита и чаще встречалось у пациентов, которые перенесли ортотопическую трансплантацию печени. Выявлено, что род Veillonella также вовлечен в патогенез таких фиброзных состояний, как цирроз и фиброз легких.
Склерозирующий холангит и язвенный колит. Среди всех пациентов, у которых склерозирующий холангит сочетался с воспалительным заболеванием кишечника, язвенный колит встречается приблизительно у 80%, болезнь Крона и недифференцированный колит – по 10%. Поэтому в большинстве исследований сравниваются клиническое течение и риск развития злокачественных новообразований при сочетании склерозирующего холангита с воспалительными заболеваниями кишечника и при изолированном язвенном колите. Клиническая картина и течение склерозирующего холангита в сочетании с воспалительным заболеванием кишечника варьируют. Колит в этом случае имеет тенденцию к более мягкому течению, характерно отсутствие эндоскопической активности у пациентов с гистологически активным колитом.
Аналогично холангит может протекать бессимптомно у пациентов с воспалительными заболеваниями кишечника. По этой причине современные рекомендации включают скрининговое обследование пациентов с воспалительными заболеваниями кишечника для выявления склерозирующего холангита и требуют проведения функциональных проб печени ежегодно, независимо от наличия или отсутствия симптомов ее поражения. Важно отметить, что этот же интервал между скрининговыми обследованиями для оценки функции печени рекомендуется у пациентов с язвенным колитом, перенесших колэктомию, поскольку они по-прежнему подвержены повышенному риску развития склерозирующего холангита по сравнению с общей популяцией. Если обнаруживаются лабораторные изменения, характерные для холестатического поражения печени, то показано визуализирующие исследования – холангиография. Магнитно-резонансная холангиопанкреатография предпочтительнее эндоскопической ретроградной холангиопанкреатографии, так как имеет хорошую диагностическую точность и не связана с рисками, которые влечет за собой эндоскопическая ретроградная холангиопанкреатография.
Склерозирующий холангит и болезнь Крона. Фенотип склерозирующего холангита в сочетании с болезнью Крона значительно отличается от такового при классическом течении болезни Крона. В частности, изолированное вовлечение подвздошной кишки при склерозирующем холангите–болезни Крона встречается редко – в 2–5% случаев по сравнению с 30% при типичном течении болезни Крона. Таким образом, распространенность колита и илеоколита при склерозирующем холангите и болезни Крона выше, чем при изолированной болезни Крона.
Особенности склерозирующего холангита при воспалительных заболеваниях кишечника. Сочетание со склерозирующим холангитом придает специфику фенотипу воспалительного заболевания кишечника. Морфологическое исследование не выявило существенных различий по степени выраженности перидуктального фиброза, перидуктального воспаления, портального отека или фиброза у пациентов со склерозирующим холангитом и склерозирующим холангитом в сочетании с язвенным колитом. Клинически исходы склерозирующего холангита, включая выживаемость без трансплантата, частоту развития цирроза и смертность, достоверно не различаются у пациентов со склерозирующим холангитом с воспалительным заболеванием кишечника и без такового. В ряде исследований получены более высокие показатели заболеваемости и смертности вследствие патологии печени у пациентов со склерозирующим холангитом и язвенным колитом по сравнению с больными склерозирующим холангитом или склерозирующим холангитом с болезнью Крона.
Исследования взаимосвязи активности воспалительного заболевания кишечника и исходов склерозирующего холангита показали, что колэктомия, в частности, была вмешательством, которое влияло на активность заболевания печени. C. Nordenvall и соавт. [58] при обследовании более чем 200 пациентов обнаружили, что ранняя колэктомия, даже до установления диагноза склерозирующего холангита, была связана со снижением риска трансплантации печени и смертности. Кроме того, L. Lindström и соавт. обнаружили, что пациенты со склерозирующим холангитом в сочетании с воспалительным заболеванием кишечника, которым была проведена колэктомия до трансплантации печени, имели меньший риск рецидива склерозирующего холангита.
Заключение. Характеристики фенотипа склерозирующего холангита в сочетании с воспалительным заболеванием кишечника клинически значимы, поскольку помогают как в диагностике, так и в лечении пациентов. Склерозирующий холангит в сочетании с воспалительным заболеванием кишечника обычно ассоциируется с панколитом; эндоскопически визуализируемая активность воспалительных заболеваний кишечника значительно ниже, а клинические симптомы менее выражены. Существует повышенный риск развития злокачественных новообразований при сочетании склерозирующего холангита с воспалительным заболеванием кишечника. Клиницисты должны сохранять бдительность в отношении злокачественных новообразований у таких пациентов.
Источник: Склерозирующий холангит и воспалительные заболевания кишечника: что первично?
Никитин А.В., Волынец Г.В.
Российский вестник перинатологии и педиатрии, 2021; 66:(1)
Метки: научные исследования
26.04.2021
 — Статьи — Хирургия — ХИЛОТОРАКС У КОШЕК. ДИАГНОСТИКА И МЕТОДЫ ЛЕЧЕНИЯ/Chylothorax in cats. Diagnosis and various methods of treatment
- О журнале
- Реклама в журнале
- Реклама на сайте
- Рубрики
- Анестезиология
- Болезни лошадей
- Ветеринарное образование
- Визуальная диагностика
- Действующие лица
- Дерматология
- Диетология
- Законодательство
- Зоопсихология
- Из практики
- Интенсивная терапия
- Интервью номера
- Кардиология
- Консультации эксперта
- Лабораторная диагностика
- Менеджмент
- Микология
- Неврология
- Нефрология
- Новые технологии
- Онкология
- Ортопедия
- Офтальмология
- Паразитология
- Патоморфология
- Pharma
- Стоматология
- Стратегии
- Терапия
- Хирургия
- Экзотические животные
- Эндокринология
- Эпизоотология
- Фотогалерея
- Новости
ХИЛОТОРАКС У КОШЕК. ДИАГНОСТИКА И МЕТОДЫ ЛЕЧЕНИЯ/Chylothorax in cats. Diagnosis and various methods of treatment
УДК: 619:616.131
Аннотация
В статье описаны различные методы диагностики хилоторакса и методы хирургического лечения.
Summary
The article describes various methods for the diagnosis of chylothorax and methods of surgical treatment.
Введение
Хилоторакс – прогрессирующее накопление хилезной жидкости (лимфы с большим содержанием липидов) в плевральной (рис. 1) полости, обусловленное его истечением из грудного протока.
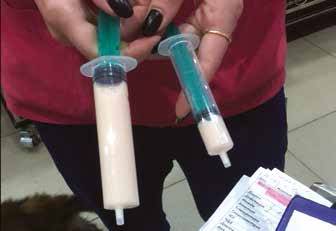
Рис. 1. Жидкость аспирированная из плевральной полости кошки при хилотораксе
Считается, что накопление хилезного выпота происходит вторично по отношению к уменьшенному дренированию лимфы по грудному лимфатическому протоку в краниальную полую вену. Пациенты с хилотораксом должны оцениваться по первичной или основной причине их выпота. Таковыми причинами являются первичная сердечная патология (кардиомиопатия, дирофиляриоз, пороки правых отделов сердца), перикардиальный выпот, неоплазия, травма грудного лимфатического протока, тромбоз полой вены. При невозможности выявления первичной причины выпота применяют термин идиопатический хилоторакс [6].
Диагностика сводится к визуальным и лабораторным методам.
После стабилизации состояния и улучшения дыхательного статуса необходимо выполнить рентгенологическое исследование для исключения новообразований в органах грудной клетки и средостения. Необходимо исключить кардиопатологии (ЭХОКГ), а также травму грудного лимфатического протока (КТ и лимфангиография) [4,5,6]. (Рис. 2).
Рис. 2. Лимфангиография, выполненная путем введения контрастного агента в подколенный лимфатический узел или семенник
(собственность Андрея Герасимова и Марии Азаровой, СПБ)
В биохимическом анализе крови зачастую выявляют гипоальбуминемию и гипопротеинемию. При исследовании выпота обнаруживается большое количество триглицеридов, а при микроскопии определяется большое количество лимфоцитов. Также необходимо исключить вирусы лейкемии (FeLV) и иммунодефицита кошек (ВИК).
Лечение хилоторакса должно быть направлено на исправление первичного заболевания, если диагностируется основная причина выпота [1,2,3,6].
Существуют как консервативные, так и хирургические методы лечения хилоторакса.
Консервативное лечение идиопатического хилоторакса сводится к диете с низким содержанием жиров, назначении рутина, октреотида, а также аспирации жидкости из плевральной полости по мере необходимости. Отсутствие хилоторакса при данном лечении трудно отличить от спонтанного разрешения, однако такое разрешение более вероятно в случае травматического хилоторакса. Продолжительность лечения консервативным методом у кошек и собак может составлять от 2 до 8 недель, но может быть и более быстрым – 1-2 недели в случае травматической причины проблемы хилоторакса [6]. Осложнения при повторяющихся торакоцентезах бывают редко, но среди них травматизация легкого, инфицирование плевральной полости при несоблюдении принципов асептики и антисептики.
Хирургическое вмешательство рассматривается, если пациент не отвечает на консервативное лечение. Общепринятыми хирургическими методами и комбинациями у собак и кошек являются лигирование грудного лимфатического протока (TDL), TDL с перикардэктомией, абляция цистерны хили с TDL, эмболизация грудного лимфатического протока, плевроперитонеальное шунтирование.
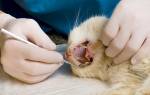
Традиционная методика проведения хирургического лечения кошек в нашей операционной проходит следующим образом. Пациент позиционируется на правом боку. Вся левая боковая поверхность тела от подмышечной области до топографического расположения маклока подготавливается с соблюдением принципа аспетики и антисептики. Отступив от крайнего ребра 2 см, мы выполняем паракостальную минилапаротомию (рис. 3).
В В В В В В В В В
Рис. 3. Парокостальная минилапаротомияВ В Рис. 4. Подготовка перед введением контрастного агента в мезентериальный лимфатический узел
Цель данного приема – выполнение доступа к системе мезэнтериальных лимфатических узлов для проведения контрастирования и процедуры интраоперационной визуализации грудного лимфатического протока и цистерны хили (рис. 4).В
После визуализации любого из мезентериальных лимфатических узлов в него с помощью инсулиновой иглы делается инъекция контрастного агента (йогексол в объеме 0,5-1,5 мл на исследование кошки, в зависимости от качества контрастирования). Далее выполняется серия интраоперационных рентгеновских снимков или рентгеноскопическое исследование в режиме 4-8 fps/сек. Выполняется оценка рентгенографической анатомии цистерны хили и грудного лимфатического протока (рис. 5-8) .В
В В В В В В В В В
Рис. 5. Пример лимфангиографии и заполнение контрастомВ В В Рис. 6. Пример лимфангиографии №2 и заполнение контрастом
цистерны хили. Окрашен лимфатический сосудВ В В В В В В В В В В В В В цистерны хили, также окрашен лимфатический сосуд.
В В В В В В В В
Рис. 7. Пример лимфангиографии. Окрашен груднойВ В В В В В В Рис. 8. Пример лимфангиографии. Окрашен грудной лимфатический проток.
лимфатический протокВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В Состояние после операции.
Контрастное исследование помогает определить наиболее оптимальный межреберный промежуток для выполнения лигирования грудного лимфатического протока. Традиционным местом латеральной торакотомии для ЛГЛП являются 9-10 межреберья, однако важным фактором является зона крепления диафрагмы и возможность выполнения лигирования максимально близко к ней. Торакотомия выполняется слева в верхней трети, в выбранном по результатам мезентериальной лимфангиографии межреберном промежутке (рис. 9,10).В
рис.9В В В В В В рис.10В В В В В В В В рис. 11В
Рис. 9. Вид операционной раны.В В В В В Рис. 10. Введение красителя В В Рис. 11. Окрашивание лимфатического сосуда после введенияВ
и латеральная торакотомия
Рассечение тканей для торакотомного отверстия выполняется в привычной хирургу манере. Для ретракции межреберного промежутка можно использовать ранорасширитель Weitlaner или педиатрический реберный дистрактор Finochetto. После формирования доступа и визуализации аорты (аорта является маркером зоны диссекции ГЛП) вновь выполняется пункция мезентериального лимфатического узла в брюшной полости и вводится краситель для интраоперационной навигации и определения ГЛП [8] (рис. 11-13).В
рис.12В В В В В В В В В В В В В В рис.13В
Рис. 12. Окрашивание цистерны хили после введения красителя;В В Рис. 13. Окрашивание грудного лимфатического протока выше
аорты (кадаверный материал)
В В В В В В В В В В В В В В В
Рис. 14. Лимфангиография после успешного клипированияВ грудного
лимфатического протока.В Отмечается отсутствие тока
контрастного агента по ГЛП
Рис. 15 Инфильтрация ретроперитонеального
пространства контрастным агентом после абляции
цистерны хили
Абляцию цистерны хили в один этап с лигированием ГЛП мы выполняем только в случае отличной визуализации цитерны интраоперационно через парокостальный лапаротомический доступ, так как нередко бывают ситуации плохой визуализации и необходимости дополнительного доступа, что может значительно увеличить продолжительность операции и травму (рис. 15). В свою очередь, АЦХ может быть применена как монометод, так и в сочетании с субфренальной перикадэктомией при неэффективности ЛГЛП как монометода. Сочетание техник зачастую обусловлено возможностью их проведения у конкретного пациента в короткий временной промежуток. Ввиду вариабельности анатомии цистерны хили основным фактором в успешной абляции цистерны хили (АЦХ) является ее интраоперационное окрашивание с помощью индигокармина или любого другого стерильного биодоступного красителя.
Традиционным местом визуализации цистерны хили является область медиальнее краниального полюса левой почки и левее аорты. Зачастую цистерну хили достаточно неплохо видно после окрашивания в околопочечном жиру между левой почкой и левым надпочечником, но как уже было сказано, ввиду вариабельности анатомии это не всегда простая задача
После окончания операции выполняется дренирование плевральной полости с целью послеоперационного контроля за аккумуляцией хилеза и воздуха. В среднем дренирование актуально на последующие 2-3 дня, после этого дренаж удаляется. Динамическое наблюдение за результатом операции (снижение продукции и аккумуляции хилеза) мы традиционно продолжаем в течение месяца. При отсутствии эффекта рекомендуется выполнение иных техник (абляция цистерны хили, субфренальная перикардэктомия или установка постоянного дренажа – PleuralPort от Norfolk Vet Products).
В В В В В В В В В В В В В В В В В В В В В В В В В В В
В В В В В В В В В В В В В В В В В В В В В В В В В В В Рис. 16. Клипирование ГЛП с помощью клипсаппликатора и клипс Vitalitec
Выводы
Консервативное лечение хилоторакса у кошек и собак оправдано в качестве первоначального подхода в тех случаях, которые возможны с медицинской или спонтанной точки зрения [6,9].
Хирургический подход будет оправдан, если консервативное лечение не дало результатов, а количество транссудата остается неизменным, без видимых уменьшений.
Публикации журнала Veterinary Surgery за несколько лет показывают эффективность методики лигирования ГЛП совместно с выполненной перикардэктомией [11,12].
Лигирование ГЛП методом «En Bloc», показало хорошие результаты согласно публикации журнала Veterinary Surgery. Оно отличается отсутствием необходимости в дополнительном лапаротомическом доступе, а также в контрастировании ГЛП и лимфангиографии. Соответственно, снижается количество затраченного времени на операцию, но не исключается возможность персистенции мелких браншей ГЛП, что может привести в дальнейшем к возможной дополнительной операции, которая будет служить той же цели, что и предыдущая [10].
В нашей операционной бригаде принято отдавать предпочтение методу, при котором требуется минимальное количество доступов и затраченного времени, с максимально возможной эффективностью. Наша цель – в первую очередь лигировать ГЛП, и сделать ангиографию для исключения проходимости и персистенции мелких браншей ГЛП. В дальнейшем, по возможности, провести АЦХ, если имеется хорошая визуализация. Это не требует дополнительный доступ и не приведет к увеличению времени операции. Меньшее время нахождения пациента в состоянии наркоза лучше сказывается на общем состоянии животного, которое зачастую и без того ослаблено. При отсутствии улучшений после лигирования ГЛП как монометода, возможно выполнение АЦХ с более точной навигацией и совместной перикардэктомией [7].
Примечание: авторы декларируют отсутствие конфликта интересов.
Литература
1.В Birchard SJ, Ware WA, Fossum TW, et al: Chylothorax associated with congestive cardiomyopathy in a cat. J Am Vet Med Assoc 1986; 189:1462–1464.
2.В Fossum TW, Miller MW, Rogers KS, et al: Chylothorax associated with right-sided heart failure in п¬Ѓve cats. JAmVet Med Assoc 1994;204:84–89.
3.В Campbell SL, Forrester SD, Johnston SA, et al: Chylothorax associated with constrictive pericarditis in a dog. J Am Vet Med Assoc 1995;206:1561–1564.
4.В Meincke JE, Hobbie WV, Barto LR: Traumatic chylothorax with associated diaphragmatic hernias in the cat. J Am Vet Med Assoc 1969;155:15–20.
5.В Fossum TW, Miller MW, Rogers KS, et al: Chylothorax associated with right-sided heart failure in п¬Ѓve cats. JAmVet Med Assoc 1994;204:84–89.
6.В Birchard SJ, McLoughlin MA, Smeak DD: Chylothorax in the dogs and cat: a review. Lymphology 1995;28:64–72.
7.В Jonathan F. McAnulty, DVM, PhD. Prospective Comparison of Cisterna Chyli Ablation to Pericardectomy for Treatment of Spontaneously Occurring Idiopathic Chylothorax in the Dog. Veterinary Surgery 40 (2011), 926–934.
8.В Benjamin J. Bayer, DVM, Diplomate ACVS, Mauricio Dujowich, DVM, Diplomate ACVS, Alexander I. Krebs, DVM, Timothy G. Leeds, MD, FACOG, Gregory M. Anderson, DVM, Diplomate ACVS, and David F. Merkley, DVM, Diplomate ACVS. Injection of the Diaphragmatic Crus With Methylene Blue for Coloration of the Canine Thoracic Duct. Veterinary Surgery 43 (2014), 829–833.
9.В Carlos C. Hodges, DVM, MS. Theresa W. Fossum, DVM, MS, PhD, Diplomate ACVS, and Winston Evering, DVM, PhD. Evaluation of Thoracic Duct Healing After Experimental Laceration and Transection. Veterinary Surgery, 22, 6,431 -435, 1993.
10. NICHOLAS J. MACDONALD, BVetMed, MVM, PETER-JOHN M. NOBLE, BVM&S, PhD, and RACHEL D. BURROW, BVetMed, Diplomate ECVS. Efп¬Ѓcacy of En Bloc Ligation of the Thoracic Duct: Descriptive Study in 14 Dogs. Veterinary Surgery 37:696–701, 2008.
11. Theresa W. Fossum, Michelle M. Mertens, Matthew W. Miller, John T. Peacock, Ashley Saunders, Sonya Gordon, Galen Pahl, Lori A. Makarski, Anne Bahr, and Phil H. Hobson. Thoracic Duct Ligation and Pericardectomy for Treatment of Idiopathic Chylothorax. J Vet Intern Med 2004;18:307–310.
12. David A. Allman, DVM, Maryann G. Radlinsky, DVM, MS, Diplomate ACVS, Alan G. Ralph, DVM, and Clarence A. Rawlings, DVM, PhD, Diplomate ACVS. Thoracoscopic Thoracic Duct Ligation and Thoracoscopic Pericardectomy for Treatment of Chylothorax in Dogs. Veterinary Surgery 39:21–27, 2010.
В
Назад в раздел Статьи подрубрики фармакология: ИСТОКИ ПОСТКОВИДА НАДО ИСКАТЬ НА МОЛЕКУЛЯРНОМ УРОВНЕ 20 декабря 2021
Лонг–ковид или постковидный синдром — относительно недавно введенное в оборот понятие. Причем оно имеет отношение практически ко всем разделам медицины. На сегодняшний день это действительно становится большой проблемой.
СРЕДСТВА, БЛОКИРУЮЩИЕ АНГИОТЕНЗИННЫЕ АТ1–РЕЦЕПТОРЫ 24 ноября 2021
В нашем организме ренин–ангиотензин–альдостероновая система (РААС) представляет собой сложный ферментативно–гормональный биологический процесс. Данная система принимает активное участие в поддержании нормальных показателей артериального давления, обеспечивает водно–солевое равновесие в организме и поддерживает кислотно–щелочной баланс крови.
ГЕПАТОПРОТЕКТОРЫ (Ч. 3) 20 июля 2021
В этой части обратим внимание на препараты, содекржащие комплекс БАВ, липотропные ЛП и др., применяемые в терапии заболеваний печени.
ГЕПАТОПРОТЕКТОРЫ (Ч. 2) 30 июня 2021
Эссенциальные фосфолипиды необходимы для роста, развития и нормального функционирования всех соматических клеток. Это главные компоненты клеточных мембран, пластический материал поврежденных клеток печени.
ГЕПАТОПРОТЕКТОРЫ 26 мая 2021
Гепатопротекторы являются лекарственными средствами, повышающими устойчивость клеток печени к воздействию повреждающих факторов.
Для защиты слизистой оболочки желудочно–кишечного тракта (ЖКТ) от воздействия всевозможных агрессивных раздражителей применяют гастроцитопротекторные средства.
Преферанская Нина Германовна Доцент кафедры фармакологии института фармации им. А.П. Нелюбина Первого МГМУ им. И.М. Сеченова (Сеченовский университет), к.фарм.н.
Они повышают резистентность слизистых оболочек ЖКТ к действию повышенной активности пепсина или сильнокислой реакции желудка (рН 0,8–1,5). Гастроцитопротекторные средства стимулируют образование муцина железистыми клетками и слизистой оболочкой желудка, тем самым сохраняют целостность его защитного барьера. Препараты способствуют поддержанию рН желудочного сока на уровне 3,0-3,5 за счет повышения секреции бикарбонатов. При их применении повышается синтез защитных факторов (простагландинов) и уменьшается их инактивация. Улучшается регенерация клеток слизистой желудка за счет уменьшения повреждения микрососудов и улучшения регионарного кровотока. Стимулируется эпидермальный фактор роста, повышается барьерная функция слизистой оболочки. Стимулируется пролиферация и обмен эпителиальных клеток. Все это значительно улучшает репаративные процессы и способствует восстановлению дескваминированного (лат. desquamo — удаляю, отслаиваю) эпителия в желудке.
С этой целью применяют несколько подгрупп гастроцитопротекторных лекарственных средств:
1. Синтетические аналоги простагландинов — Мизопростол.
2. Препараты, повышающие синтез простагландинов — Ребамипид.
3. Препараты, образующие комплексные соединения (хелаты), — Висмута трикалия дицитрат, Сукралфат.
4. Препараты висмута: Висмута субнитрат, Викалин, Викаир.
5. Препараты природного происхождения — Солкосерил, Мумие и др.
Гастроцитопротекторные ЛС отличаются между собой не только составом, но и фармакологическими эффектами. Каждое лекарственное средство по-разному защищает слизистую оболочку и стимулирует восстановление клеток стенки желудка.
ГОРМОНОПОДОБНЫЕ ЛИПИДНЫЕ МЕДИАТОРЫ
Многочисленные исследования показали, что простагландины повышают устойчивость слизистой оболочки желудка к воздействию травмирующих факторов (соляной кислоте, пепсину, желчи, этанолу, НВПС, ГКС). Связано это с их влиянием на физиологические функции организма. НПВС и ГКС нарушают образование простагландинов Е и I2 Первым препаратом этой группы является синтетический аналог простагландина Е1 — Мизопростол (Misoprostol) — ТН “Миролют” —активирует регенерацию слизистой оболочки, усиливает кровообращение в микрососудах стенки желудка, подавляет выработку пищеварительного фермента пепсина и уменьшает продукцию желудочного сока. Он повышает воспроизводимость особыми (добавочными) клетками желудочной слизи, которая защищает его стенки от агрессивных факторов. Препарат оказывает слабое стимулирующее действие на гладкую мускулатуру ЖКТ антисекреторной активностью. Повышается устойчивость слизистой оболочки желудка, что предупреждает развитие эрозивно–язвенных поражений. Прием чаще назначают для профилактики НПВС–гастропатий. Самостоятельно Мизопростол лучше не назначать, даже если в качестве основного лекарства был назначен аспирин, который почему-то многие пациенты принимают не по назначению и довольно часто. У больных, принимающих НПВС, уменьшается частота развития язв желудка и двенадцатиперстной кишки, снижается риск язвенного кровотечения.
Важно! Препарат противопоказан при ИБС, гипертонической болезни, нарушении функции печени, беременности. Не рекомендуют принимать детям и подросткам. Простагландины опасны побочными эффектами, они вызывают: метеоризм, диарею, тошноту, головную боль, нарушение менструального цикла, вагинальные кровотечения и др.
Перед приемом препарата необходимо обязательно проконсультироваться у лечащего врача.
Ребамипид (Rebamipidum) — ТН “Ребагид” — оказывает цитопротекторное действие в отношении слизистой желудка при повреждающем воздействии этанола, кислот, щелочей и лекарственных средств (НПВС, ГКС). Способствует активации энзимов, ускоряющих биосинтез высокомолекулярных гликопротеинов, и повышает содержание слизи на поверхности стенки желудка. Ребамипид повышает содержание простагландина Е2 (PGE2) в слизистой желудка и повышает содержание PGI2 в желудке. Способствует улучшению кровоснабжения слизистой желудка, активизирует ее барьерную функцию, активизирует щелочную секрецию желудка, усиливает пролиферацию и обмен эпителиальных клеток желудка. При приеме препарата ингибируются продукты окислительного стресса, воспалительных цитокинов и хемокинов, при этом очищает слизистую от гидроксильных радикалов и подавляет супероксиды, продуцируемые полиморфноядерными лейкоцитами и нейтрофилами в присутствии Helicobacter pylori. Абсорбция при приеме внутрь — высокая. После приема в дозе 100 мг максимальная концентрация достигается приблизительно через 2 ч и составляет 340 нг/мл. Период полувыведения равен приблизительно 1 ч. Повторные приемы препарата не приводят к его кумуляции в организме. Приблизительно 10% препарата выводится почками, преимущественно в неизмененном виде.
Препарат принимают внутрь по 1 табл. 3 раза в сутки, запивается небольшим количеством жидкости. Курс лечения составляет 2-4 недели, в случае необходимости может быть продлен до 8 недель.
Важно! При применении препарата могут возникать побочные эффекты со стороны желудочно-кишечного тракта: запор, метеоризм, диарея, тошнота, боль в области живота, нарушение вкусовых ощущений, а также аллергические реакции и нарушение менструального цикла.
ЛП, ОБРАЗУЮЩИЕ ЗАЩИТНУЮ ПЛЕНКУ ИЗ МЕТАЛЛООРГАНИЧЕСКИХ КОМПЛЕКСОВ
Висмута трикалия дицитрат (Bismuthi trikalii dicitras) — ТН “Де–нол“, ТН “Новобисмол“,табл. 120 мг. В кислой среде желудка препарат образует нерастворимые висмута оксихлорид и дицитрат. Соединение дицитрата с гидроокисью висмута образует молекулярные комплексы различной структуры и размеров, что приводит к переходу водного раствора в коллоидную форму. Коллоидная форма препарата позволяет ему эффективно пенетрировать в желудочную слизь. Препарат хорошо проникает в глубь желудочных ямок, что позволяет ему уничтожать бактерии, находящиеся в недосягаемости для других антибактериальных препаратов. Обладает антихеликобактерным действием, которое проявляется в виде коагуляции белков микробной клетки и гибели спиралевидной жгутиковой грамотрицательной бактерии Helicobacter pylori. При применении препарат практически не всасывается из ЖКТ, выводится в основном с экскрементами.
Сукральфат (Sucralfatum) — ТН “Вентер“, табл. 1,0 г — препарат смешанного типа действия: в желудке распадается на два активных метаболита: алюминия гидроокись, обладающую антацидным действием и сульфат сахарозы, который взаимодействует с белками некротизированной ткани, образуя хелатный комплекс, в виде клейкой массы, которая выстилает и защищает язву от повреждения. Алюминия гидроокись оказывает антацидное действие, нейтрализует соляную кислоту и повышает рН содержимого желудка. Основными побочными эффектами являются диспептические расстройства и аллергические реакции.
Препараты висмута обладают вяжущим, адсорбирующим и обволакивающим действием.
Висмута субнитрат (Bismuthi subnitras) — препарат на поверхности слизистой оболочки желудка коагулирует белки, образуя защитную пленку из денатурированных белков с образованием плотного альбумината. Оказывает сосудосуживающий эффект, уменьшает местный воспалительный процесс, подавляет рост и развитие Helicobacter pylori. Кроме того, препараты висмута обладают местной антимикробной активностью, действуя непосредственно на клеточную стенку бактерий, нарушают ее целостность. Висмут оказывает непосредственное бактерицидное действие, его минимальная ингибирующая концентрация в отношении Helicobacter pylori достаточна высокая.
При применении этого препарата могут возникать тошнота, рвота, головная боль, пигментации на языке и аллергические реакции.
Викалин (Vicalin), табл., покр. обол., — комбинированный препарат, в одной таблетке которого содержатся активные компоненты: висмута субнитрат (350 мг), магния карбонат — 400 мг, натрия гидрокарбонат (200 мг), кора крушины ольховидной (25 мг), корневище аира болотного (25 мг), рутозида + келлина по 5 мг.
Препарат обладает репаративными свойствами, оказывает вяжущее, адсорбирующее, обволакивающее действие. Дополнительно викалин проявляет спазмолитический, слабительный, притивовоспалительный эффект. При применении препарата снижается кислотность желудочного сока и уменьшается активность пепсина, возникает антацидное и бактерицидное действие. При применении викалина могут возникать учащение стула, тошнота, головная боль и аллергические реакции Таблетки применяют внутрь через 30-60 мин. после еды, запивая достаточным количеством теплой воды (0,5 стакана). Отмечается быстрое действие, хорошая переносимость и доступная стоимость препарата. Применение препарата запрещено больным детям в возрасте до 18 лет, при почечной недостаточности, беременным и во время кормления грудью.
Препарат назначается взрослым по 1–2 таблетки 3-4 раза в сутки за 30 мин. до или через 2 часа после последнего приема пищи; детям от 6 до 14 лет можно по 1 табл. 2 раза в день, запивая небольшим количеством воды. Курс лечения — 28-56 дней, перерыв — 8 недель.
Важно! Во избежание накопления в организме висмута, особенно при снижении выделительной функции почек, длительные курсы приема препарата не рекомендуются. При применении препарата может возникать тошнота, рвота и металлический привкус во рту.
Викаир (Vicair) — препарат в комбинации висмута субнитрата (350 мг), коры крушины ольховидной (400 мг), корневища аира болотного (200 мг), магния карбонат + натрия гидрокарбонат по 25 мг. Эффект препарата обусловлен свойствами его компонентов. В состав данного средства входит аир, обладающий спазмолитическим действием, крушина, обладает слабительным действием, способствуя улучшению пассажа по кишечнику. Препарат проявляет вяжущее, антацидное действие.
Режим дозирования индивидуальный, в зависимости от показаний, возраста пациента и клинической ситуации. Препарат противопоказан при гипоацидном гастрите, хронической почечной недостаточности, хроническом аппендиците, энтероколите, детском возрасте до 18 лет, беременности, в период лактации и при повышенной чувствительности к компонентам комбинации.
Важно! Длительно принимать препараты висмута нельзя, т.к. они вызывают различные побочные эффекты: дисфункцию кишечника, проявляющуюся запором или поносом, нарушают работу почек, печени, могут стать причиной бессонницы, энцефалопатии, снижения памяти.
ПРЕПАРАТЫ РАСТИТЕЛЬНОГО И ЖИВОТНОГО ПРОИСХОЖДЕНИЯ
Препараты, с успехом используемые для улучшения репаративных процессов: Солкосерил, Алоэ, Зверобой, Прополис, Мумие.
Солкосерил — зарекомендовавшее себя эффективное средство при язве желудка, изготовленное из телячьей крови. Это средство изобретено давно и используется как сильнодействующее ранозаживляющее средство и сейчас.
Это биогенный стимулятор, он быстро и эффективно устраняет симптомы болезни, уменьшает воспалительный процесс. Он активизирует процессы регенерации и метаболизма в организме, убирает воспаление. Солкосерил запускает механизм самооздоровления, происходит саморегуляция нарушений слизистой пищеварительного органа. И не только желудку становится легче, но и печени. Препарат выводит из организма накопившиеся из-за недуга токсичные вещества.
Его основное назначение — стимулировать кровоснабжение слизистой пищеварительного органа, ускорять рубцевание язв; активировать регенеративные возможности клеток, предупреждать атрофию слизистой желудка; улучшать обмен веществ и иммунитет.
Метилметионинсульфония хлорид (Витамин U) оказывает обезболивающий эффект и стимулирует заживление поражений слизистых оболочек. При его применении организм больного насыщается метильными группами, которые необходимы для биохимических процессов синтеза. Участвует в метилировании гистамина, превращая его в неактивную форму, что способствует уменьшению желудочной секреции. Назначают внутрь 2 табл. 3 раза в день, курс лечения — месяц, при необходимости курс повторяют.
Фитопрепараты, содержащие цветы ромашки аптечной, слизь семян льна, листья подорожника, траву зверобоя, обладают обволакивающим и вяжущим действием. Они менее эффективны, но их можно применять в качестве профилактического средства, предварительно посоветовавшись с гастроэнтерологом, аллергологом (у растительных препаратов также есть противопоказания к применению).
Биогенные стимуляторы — экстрат алоэ, сок каланхоэ, ФИБС, масло облепихи и шиповника — улучшают тканевую регенерацию.
Облепиховое масло благодаря содержанию токоферолов защищает биологические мембраны от повреждения, обладает умеренным ингибирующим влиянием на секрецию желудочного сока и ускоряет процесс заживления язв. Больным с локализацией язвы в желудке и двенадцатиперстной кишке назначают по 1 ч. л. за 30 мин. до еды 2–3 раза в день и на ночь. Для внутреннего применения противопоказано при воспалительных процессах в желчном пузыре, печени, поджелудочной железе и при желчнокаменной болезни.
Врач-гастроэнтеролог перед назначением препарата учитывает все его характеристики: механизмы и эффекты действия, отрицательные виды действия, побочные эффекты, противопоказания и индивидуально подбирает необходимое средство. Своевременное обращение к гастроэнтерологу и правильное применение гастроцитопротекторных средств позволяет больным нивелировать фазу обострений и оптимизировать фазу ремиссий.
10.06.2020 Аптека // Фармакология Оставлять комментарии могут только члены Клуба. Авторизоваться. Вступить в Клуб.